 Открытие радиоактивности Открытие радиоактивности
В конце XIX века в научном мире происходили удивительные и необычайно интересные события, которые положили начало новому этапу в формировании физической картины мира. В 1895 году Вильгельм Конрад Рентген проводил эксперимент по прохождению электрического разряда сквозь разреженные газы и наблюдал при этом неизвестное ранее излучение. Это излучение получило название X-лучей, или рентгеновских лучей. Излучение обладало уникальной проникающей способностью и нашло широкое применение в медицине и технике. В 1901 году Вильгельм Рентген стал первым в истории лауреатом Нобелевской премии по физике «в знак признания необычайно важных заслуг перед наукой, выразившихся в открытии замечательных лучей, названных впоследствии в его честь». Вильгельм Конрад Рентген В 1896 году Антуан Анри Беккерель, исследуя рентгеновское излучение и явление флуоресценции, завернул кристаллы соли урана в чёрную светонепроницаемую бумагу и положил свёрток на фотопластинку. Через несколько дней, после проявления фотопластинки, он обнаружил на ней чёткое изображение кристаллов. Это означало, что соли урана самопроизвольно, без каких-либо внешних влияний, создают какое-то излучение. Это явление получило название самопроизвольной радиоактивности. В 1903 году Анри Беккерель стал лауреатом Нобелевской премии «в знак признания исключительных услуг, которые он оказал науке своим открытием самопроизвольной радиоактивности».  Антуан Анри Беккерель Исследованием нового явления занялись французский физик Пьер Кюри и его жена Мария Склодовская-Кюри. Изучив большое количество разнообразных минералов, Мария Кюри обнаружила, что похожие лучи испускает не только уран, но и другие элементы. В 1898 году было обнаружено излучение тория. В дальнейшем из руд, содержащих уран и торий, был выделен новый неизвестный ранее химический элемент — полоний, который назвали в честь родины М. Склодовская-Кюри — Польши. Следующим химическим элементом, который открыли при изучений урановых руд, стал радий. Именно Мария Кюри предложила название «радиоактивность» (англ. слово radiation — излучение, лучеиспускание) для нового вида излучения. В 1903 году Мария и Пьер Кюри получили Нобелевскую премию «за выдающиеся заслуги в развитии химии: открытие элементов радия и полония, выделение радия и изучение природы и соединений этого замечательного элемента».  Мария Склодовская-Кюри  Пьер Кюри Обрати внимание! Впоследствии было установлено, что все химические элементы с порядковым номером более 82 являются радиоактивными. Активность полония и радия во много раз превосходила активность излучения урана. Открытие этих элементов стало большой сенсацией в научном мире. При радиоактивном излучении образовывались новые химические элементы, что ставило перед учёными вопрос о строении атома. Электрон Долгое время атом считался наименьшей неделимой частицей вещества. Такое представление об атоме было разрушено в 1897 году. Этот год считается датой открытия элементарной частицы — электрона. В конце XIX века английский физик Джозеф Джон Томсон занимался изучением «катодных лучей». Джозеф Джон Томсон Этот вид излучения наблюдался при пропускании электрического тока через разреженные газы. Схема установки, которую использовал Томсон, представлена на рисунке ниже. Ток между анодом (1) и катодом (2) проходит через колбу, заполненную разреженным газом. Через узкую щель (3) «катодный луч» попадает в электрическое поле (4) и отклоняется. По шкале (5) можно определить угол отклонения луча от начального направления. Отклонение луча означает, что луч — это поток отрицательно заряженных частиц, которые получили название «электроны». По углу отклонения луча от первоначального направления Томсону удалось измерить удельный заряд электрона q/m, который оказался приблизительно в 2000 раз больше, чем у иона водорода, удельный заряд которого уже был известен к тому времени. А это означало, что при том же заряде масса электрона примерно в 2000 раз меньше, чем масса иона водорода. Заряд электрона равен элементарному электрическому заряду: e=−1,6⋅10−19 Кл. Масса электрона: me=9,1⋅10−31 кг. В 1906 году за открытие электрона Томсон стал лауреатом Нобелевской премии. Так как колба с газом была герметично запаяна, то электронам было неоткуда взяться, кроме как из атомов газа, через который проходил электрический ток. А значит, атом не мог быть неделимой частицей! Перед учёными стал вопрос о том, как же всё-таки устроен атом. Обрати внимание! Открытие электрона доказывало, что атом не является неделимой частицей. Модель Томсона Сам Томсон предположил, что атом представляет собой равномерно распределённый по всему объёму атома положительный заряд. Внутри такого положительно заряженного «облака» содержатся маленькие отрицательно заряженные электроны, которые расположены случайным образом, как изюм в тесте пудинга. Суммарный заряд электронов по модулю равен заряду «облака», поэтому атом в целом нейтрален. Такая модель строения атома получила название «пудинговая модель атома». Позднее Эрнест Резерфорд опроверг предположения о подобном строении атома. Его опыты по рассеянию альфа-частиц на золотой фольге позволили построить более точную модель строения атома. Эксперимент по рассеиванию альфа-частиц Открытие электрона, рентгеновского излучения и явления радиоактивности свидетельствовало о том, что представление об атоме как неделимой частице являлось неверным. К концу XIX века стало понятно, что атом должен иметь сложное строение. Большой вклад в изучение строения атома внёс физик-экспериментатор Эрнест Резерфорд.  Эрнест Резерфорд В 1904 году Резерфорд начал свои эксперименты по бомбардировке альфа-частицами тонких металлических пластин (золотых и платиновых) для изучения структуры атомов, из которых состоят пластины. Альфа-частица — ионизированный атом гелия. Альфа-частица — это массивная (масса альфа-частицы в несколько тысяч раз больше, чем масса электрона) положительно заряженная частица. Заряд альфа-частицы в два раза больше элементарного заряда. Схематично установка Резерфорда изображена на рисунке ниже. В толстостенном свинцовом футляре (1) находится радиоактивное вещество (2), излучающее поток альфа-частиц. Через небольшое отверстие (3) поток альфа-частиц направляется на тонкую золотую фольгу (4) (толщиной порядка 0,1 мк). За фольгой располагается экран, покрытый сернистым цинком (5). При столкновении альфа-частицы на экране наблюдается вспышка. Согласно модели строения атома по Томпсону, альфа-частицы должны столкнуться с большими плотными атомами и разлететься под разными углами. Однако опыт показал, что большинство альфа-частиц пролетают беспрепятственно через пластинку металла (6). И только небольшая часть всех альфа-частиц изменяет направление движения, отклоняясь на небольшие углы (7). А некоторые частицы и вовсе отлетают от фольги в обратном направлении (8). Результаты опыта были удивительными. Только в 1911 году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома. Ядерная модель строения атома Так как большинство альфа-частиц свободно проходило через фольгу, это означало, что практически всё пространство, через которое проходит поток альфа-частиц — это пустота. Где же тогда «спрятана» вся масса атома? Резерфорд предположил, что практически вся масса атома сосредоточена в очень маленьком объёме — ядре атома. Было очевидно, что ядро должно быть положительно заряжено. Когда альфа-частица пролетает достаточно близко от такого ядра, то из-за Кулоновских сил отталкивания происходит отклонение от первоначального направления движения частицы. А при столкновении с ядром частица отскакивает в обратном направлении. По расчётам Резерфорда, ядро атома должно было иметь размер примерно в 3000 раз меньший, чем атом. Остальное пространство атома должны занимать электроны. Планетарная модель строения атома Итак, стало понятно, что «пудинговая модель строения атома» неверна. На основе экспериментальных данных была предложена новая модель строения атома, которая получила название «планетарная модель строения атома». Обрати внимание! Согласно модели Резерфорда, атом состоит из очень маленького положительно заряженного ядра, размер которого в тысячи раз меньше самого атома, и электронов, которые вращаются вокруг ядра по круговым орбитам. Модель очень напоминала модель строения Солнечной системы, где вокруг массивного Солнца по круговым орбитам вращаются планеты. Таким образом, на основе планетарной модели можно было объяснить результаты опытов по рассеянию альфа — частиц. Однако объяснить стабильность атомов не удавалось. Движение электрона в атоме происходит с ускорением. В соответствии с классической электродинамикой это движение должно было сопровождаться излучением электромагнитных волн, в результате чего энергия электрона в атоме непрерывно уменьшалась бы. Электрон стал бы приближаться к ядру по спирали и должен был бы очень скоро упасть на него. Однако атомы стабильны. Следовательно, планетарная модель противоречила законам классической физики. Атомные единицы массы При изучении строения атома и атомных ядер физикам приходится обращаться с частицами очень малых масс. Поэтому для измерения массы частиц стали использовать новую единицу измерения массы — атомную единицу массы. Одна атомная единица массы равна: 1 а. е. м. =1,6605655 ⋅10−27 кг. Атомное ядро Опыты Резерфорда привели к возникновению новой модели строения атома — ядерной модели. Согласно этой модели, внутри атома находится маленькое положительно заряженное ядро, вокруг которого по круговым орбитам вращаются электроны. Так как атом заряжен нейтрально, то заряд ядра должен быть равен заряду всех электронов, которые вращаются вокруг ядра. Эрнест Резерфорд обнаружил, что при соударении альфа-частиц с атомами некоторых химических элементов появляются положительно заряженные частицы, заряд которых равен элементарному, а масса равна массе атома водорода. Эти частицы были названы протонами. mp=1,6726485 ⋅ 10−27 кг = 1,007276470 а. е. м. Было очевидно, что протоны могли вылетать только из ядер атомов. А следовательно, внутри ядра находилось столько же протонов, сколько и электронов вращается вокруг ядра. Однако масса атомов была больше, чем масса протонов и электронов. Это означало, что внутри ядра должны находиться ещё какие-то частички, заряженные нейтрально. Такие частички — нейтроны — были открыты в 1932 г. английским физиком Джеймсом Чедвиком. mn=1,6749543⋅10−27 кг = 1,008665012 а. е. м. Частицы, из которых состоит ядро атома, называются нуклонами. Такая модель строения ядра получила название — протонно-нейтронная модель. Протонно-нейтронная модель строения атома Ядерные силы Согласно протонно-нейтронной модели строения атомного ядра, в очень маленьком объёме должно находиться несколько положительно заряженных протонов. Возникали очевидные вопросы. Почему Кулоновские силы отталкивания не разрывают ядро? Какие силы удерживают протоны и нейтроны вместе? Очевидно, что эти силы действуют только на малых расстояниях (порядка 10−15 м) и должны быть значительно больше сил Кулоновского отталкивания. Такие силы были названы ядерными силами. Взаимодействие между протонами и нейтронами одинаковое, поэтому протон и нейтрон можно рассматривать как одну и ту же частицу — нуклон — в разных состояниях. Обрати внимание! Ядерные силы действуют одинаково между протоном и нейтроном, между двумя протонами и между двумя нейтронами. Зарядовое число Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что: q=eZ, где q — заряд ядра, e — элементарный заряд, Z — количество протонов в ядре. Количество протонов в ядре Z называется зарядовым числом атомного ядра. Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева. Обрати внимание! Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовым числом (Z). Массовое число Количество нейтронов в ядре атома принято обозначать N. Тогда количество протонов и нейтронов в ядре атома можно вычислить как: A=Z+N. A — количество нуклонов в атоме называется массовым числом. Изотопы Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород, дейтерий и тритий. Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода. Атомы одного и того же химического элемента, но с разными массами, называются изотопами. Так как изотопы — это атомы одного и того же химического элемента, то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов. Изотопы принято обозначать: XZA, где XZA — химический элемент, A — массовое число, Z — зарядовое число. Пример: H11 — водород, H12 — дейтерий, H13 — тритий. Дефект массы ядра Опытным путём было доказано, что масса ядра оказывается меньше, чем масса протонов и нейтронов, из которых состоит ядро. Разница между этими массами называется дефектом массы ядра. Дефект массы ядра (Δm) — это разница между суммарной массой свободных нуклонов, из которых состоит ядро, и массой ядра. Δm=Zmp+Nmn−mя. Почему же масса нуклонов, связанных ядерными силами в ядро, оказывается меньше массы этих же нуклонов в свободном состоянии? Оказывается, что масса и энергия взаимосвязаны. Всякое тело массой m обладает энергией, которая называется энергией покоя (E0): E0=mc2, где c — скорость света в вакууме. Впервые соотношение между энергией и массой вывел Альберт Эйнштейн, поэтому это выражение и получило название уравнение Эйнштейна.Энергия связи Уменьшение энергии покоя нуклонов в ядре вызвано наличием ядерных сил, которые удерживают протоны и нейтроны в ядре. Работа, которую необходимо совершить для разрыва ядерных сил и разъединения нуклонов, равна энергии, которая связывает нуклоны вместе. Эта энергия называется энергией связи (Eсв) я. Энергия связи и дефект массы ядра связаны между собой уравнением Эйнштейна: Eсв=Δmc2. Удельной энергией связи ядра называют энергию связи, приходящуюся на 1 нуклон: f=EсвA. Удельная энергия равна средней энергии, необходимой для отрыва 1 нуклона от ядра. Вычисления показали, что наибольшей удельной энергией связи обладают элементы, находящиеся в центре Периодической системы химических элементов. С увеличением порядкового номера начинает уменьшаться удельная энергия связи. Именно поэтому ядра элементов с порядковым номером больше 83 являются радиоактивными. Благодаря небольшой удельной энергии связи они способны самопроизвольно распадаться. Единицы измерения энергии В ядерной физике принято измерять энергию в мегаэлектронвольтах (1 МэВ): 1 МэВ = 106 эВ ≈1,6⋅10−13 Дж. Для вычисления энергии связи удобно пользоваться переводным коэффициентом для массы и энергии. Дефекту массы в 1 а. е. м. соответствует энергия, равная ΔE=Δmc2≈1,66⋅10−27 кг ⋅(3⋅108 м/с)2≈1,49⋅10−10 Дж =931,5 МэВ. Обрати внимание! Для выражения изменения энергии системы в мегаэлектронвольтах нужно
изменение массы системы в атомных единицах массы умножить на переводной коэффициент 931,5 МэВ/а. е. м. 1 а. е. м. = 931,5 МэВ. Радиоактивный распад 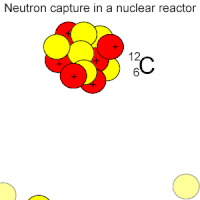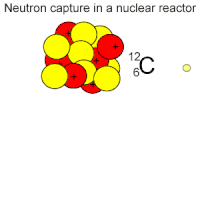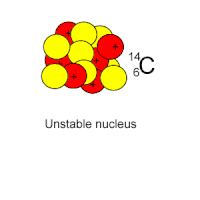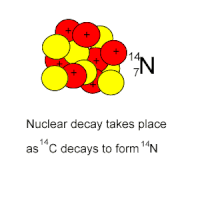 Опыты с различными радиоактивными препаратами показали, что как при α-распаде, так и β-распаде происходит превращение одного химического элемента в другой. Используя ядерную модель атома, предложенную Э. Резерфордом в Опыты с различными радиоактивными препаратами показали, что как при α-распаде, так и β-распаде происходит превращение одного химического элемента в другой. Используя ядерную модель атома, предложенную Э. Резерфордом в
1911 году, это можно объяснить изменениями, происходящими с ядрами при радиоактивных превращениях.
В уравнениях радиоактивного распада ядра атомов обозначаются так же, как и сами атомы в таблице Д. И. Менделеева. Число, стоящее перед буквенным обозначением ядра сверху, называется массовым числом, а снизу — зарядовым числом (или атомным номером). Пример: Ra88226 — обозначение ядра атома радия, зарядовое число — 88, массовое число — 226. Массовое число ядра атома данного химического элемента с точностью до целых чисел равно числу атомных единиц массы, содержащихся в массе этого ядра.
Зарядовое число ядра атома данного химического элемента равно числу элементарных электрических зарядов, содержащихся в заряде этого ядра.
Оба эти числа — массовое и зарядовое — всегда целые и положительные. Распадающееся ядро называется материнским и обозначается в уравнении радиоактивного распада XZA, ядро продукта распада — дочерним и обозначается YZA. Обрати внимание! В процессе радиоактивного распада выполняются законы сохранения массового числа и заряда, то есть массовое число и заряд материнского ядра равны соответственно сумме массовых чисел и зарядов дочернего ядра и частицы, образовавшихся в результате этого распада. Реакция альфа-распада радиоактивного атома
Альфа-распад — самопроизвольное излучение α-частиц (He24 — полностью ионизированное ядро гелия). При α-распаде радиоактивное ядро X превращается в новое ядро Y, испуская при этом α-частицу. Уравнение α-распада: XZA→YZ−2A−4+He24. Обрати внимание! В результате α-распада ядро распадающегося атома (согласно законам сохранения массового числа и заряда) теряет 4 атомные единицы массы и 2 элементарных заряда, превращаясь в ядро атома с порядковым номером в таблице Д. И. Менделеева на 2 меньше исходного. Пример: Po→84209Pb+82205He24. Массовое число (209) и заряд (84) распадающегося ядра атома полония равны соответственно сумме массовых чисел (205+4=209) и сумме зарядов (82+2=84) ядер атомов свинца и гелия. Реакция бета-распада радиоактивного атома
При бета-распаде излучается электрон e−10 (β-частица). При этом один из нейтронов превращается в протон, а ядро испускает электрон и антинейтрино. Уравнение β-распада: XZA→YZ+1A+e−10. Обрати внимание! Заряд ядра и соответственно атомный номер элемента при этом увеличивается на единицу, а массовое число остаётся без изменения. Образовавшийся элемент смещается в периодической системе на одну клетку вперёд. Пример: K1940→Ca2040+e−10. Массовое число (40) и заряд (19) распадающегося ядра атома калия равны соответственно сумме массовых чисел (40+0=40) и сумме зарядов (20+(−1)=19) ядра атома кальция и электрона. Сущность гамма-излучения
Гамма-распад — это излучение гамма-квантов (γ) ядрами в возбуждённом состоянии, при котором они обладают большей по сравнению с невозбуждённым состоянием энергией. В возбуждённое состояние ядра могут приходить при ядерных реакциях либо при радиоактивных распадах других ядер. Большинство возбуждённых состояний ядер имеют очень непродолжительное время жизни — менее наносекунды. Уравнение гамма-распада: X→YZAZA+γ00. Обрати внимание! При гамма-распаде заряд и масса ядра не изменяются. γ-излучение представляет собой один из видов, точнее диапазонов, электромагнитного излучения. Пример: I→Xe+e+2γ кванта−105413153131. Пример: Ra→Rn+He+γ квант248622288226.
Повторение
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ЗАКОНЫ И ФОРМУЛЫ |