Молекулярная физика...... строение и агрегатные состояния и плотность вещества
12.03.2019
Строение вещества. Молекулы и атомы
1.
Твёрдые
тела при нагревании расширяются.
2.
Жидкости
при нагревании также расширяются.
3.
Все вещества состоят
из отдельных частиц, между которыми есть промежутки.
С изменением
температуры промежутки между частицами вещества изменяются, поэтому изменяется
объём тела.
4.
Частицы, из которых
состоит вещество, очень малы.
5.
В
природе существует 92 различных атома, ещё около 26 атомов новых элементов
искусственно создано в лабораториях.
6.
Молекулы состоят из
атомов.
7.
Молекулы
одного вещества одинаковы.
8.
Опыт
по определению размера молекул. 
9.
Молекулы
нельзя увидеть невооружённым глазом или в обычные микроскопы.
Электронный микроскоп и атомы золота
Броуновское движение. Диффузия. Взаимное притяжение и
отталкивание молекул
2.
В
1827 г. Броун наблюдал беспорядочное движение частичек пыльцы в воде. Это
явление получило название броуновского
движения.
3.
Броуновское
движение объясняется ударами молекул воды в частицы пыльцы, которые приводят к скачкообразным
перемещениям.
4.
Явление,
при котором происходит взаимное проникновение молекул одного вещества между
молекулами другого, называют диффузией.
5.
Причиной диффузии является
непрерывное и беспорядочное движение частиц вещества.
6.
Скорость диффузии в газах –
наибольшая, в твёрдых телах – наименьшая.
7.
Между
молекулами существует взаимное
притяжение.
Притяжение между молекулами существенно, только когда они находятся очень близко друг к другу.
8.
Между
молекулами и атомами в то же время существует и отталкивание.
9.
На
расстояниях, сравнимых с размерами самих молекул и атомов, заметнее проявляется
притяжение, а при дальнейшем сближении – отталкивание.
Агрегатные состояния вещества
Вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Молекулярная физика - раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе их молекулярного строения.
Тепловое движение - беспорядочное (хаотическое) движение атомов или молекул вещества.
Состояние вещества связано с условиями, в которых оно находится. Одно и тоже вещество в различных интервалах температур и давлений может находиться в состояниях, отличающихся друг от друга по своим физическим, в первую очередь механическим свойствам. Эти состояния одного и того же вещества называются агрегатными состояниями. Примерами агрегатных состояний окиси водорода являются: лед, вода и водяной пар. Выделяют три основных агрегатных состояния: твердое, жидкое и газообразное.
Четвертым основным агрегатным состоянием вещества считается плазма. Так называют сильно ионизированный газ с высокой относительной концентрацией заряженных частиц, который в целом электрически нейтрален.
Далее такое состояние вещества нами рассматриваться не будет. Отметим только, что плазма является самым распространённым состоянием вещества во Вселенной, так как из неё состоит большинство звезд. Примером низкотемпературной плазмы, наблюдаемой в земных условиях, является пламя, представляющее собой сильно разогретый, частично ионизированный газ, возникающий в процессе горения.
Кроме плазмы во Вселенной встречаются такие специфические состояния вещества как нейтронная жидкость (из неё состоят нейтронные звезды) и вырожденная плазма (состоящая из полностью ионизированных ядер и электронов). Эти состояния встречаются при сверхвысоких давлениях и температурах.
Твердое, жидкое и газообразное состояния веществ различаются, прежде всего, подвижностью атомов и молекул, из которых состоят эти вещества. В газах и жидкостях частицы совершают хаотическое поступательное движение, а в твердых веществах - колебательное движение вокруг положения равновесия. Различие между газами и жидкостями заключается в том, что в жидкостях расстояние между молекулами сравнимо с их размерами, и поэтому потенциальная энергия взаимодействия молекул сравнима по величине с энергией их теплового движения. Это приводит к тому, что тепловое движение молекул жидкости затруднено по сравнению с молекулами газа. Потенциальной энергии взаимодействия молекул жидкости недостаточно для сохранения устойчивой межмолекулярной структуры, как это наблюдается для твердых тел. Поэтому в жидкостях, в отличие от твердых кристаллических тел, в которых существует дальний порядок, наблюдается только некоторое упорядочение положения близлежащих частиц, то есть ближний порядок. По этой причине жидкость легко принимает форму сосуда, предоставленного ей. Это отличает её от твердых кристаллических тел, в которых существует упорядоченная межатомная структура - кристаллическая решетка.
Среди твердых тел существует особый класс тел - аморфные тела, занимающие промежуточное положение между кристаллическими телами и жидкостями. Для них характерно долговременное сохранение формы, но при этом их атомы не образуют упорядоченную к
Физика, 10 класс
Жидкости и твёрдые тела
Перечень вопросов, рассматриваемых на уроке:
Модели твердого тела и жидкости;
Поверхностное натяжение жидкости;
Смачивание;
Капиллярность
Ccылка на видеоГлоссарий по теме
Кристаллическая решетка– это упорядоченное расположение атомов или молекул в определенных точках пространства.
Коэффициент поверхностного натяжения жидкости – это величина равная работе, которую необходимо совершить, чтобы увеличить площадь поверхности на единицу.
Угол смачивания – это угол, образованный поверхностью жидкости с поверхностью твердого тела, откладываемый внутри жидкости.
Основное содержание урока
Каковы главные особенности в строении жидкости и твердого тела, которые отражаются на различии их физических свойств. Главными признаками при сравнении жидкости и твердого тела являются упорядоченность в расположении частиц и расстояния между ними.
В разных условиях одни и те же вещества могут находиться в разных агрегатных состояниях: газообразном, жидком и твердом состояниях. При этом одни и те же молекулы одного и того же вещества по-разному движутся и взаимодействуют друг с другом.
По современным представлениям в жидкости молекулы колеблются относительно некоторой точки равновесия и время от времени совершают скачкообразное движение, покидая своих соседей. Такое движение молекул объясняет известное свойство жидкости, как текучесть, способность жидкости принимать форму сосуда, в котором она содержится. При соблюдается некоторый «ближний» порядок в расположении молекул.
В модели кристаллов молекулы совершают только колебательные движения около точек, которые называются узлами кристаллической решетки.
Кристаллическая решетка – это упорядоченное расположение упорядоченное расположение определенных точках пространства.
Таким образом в расположении частиц твердого тела соблюдается не только ближний, но и «дальний» порядок, распространяющийся по всем направлениям кристалла.
Фаза – это равновесное состояние вещества, отличающееся по своим физическим свойствам от других состояний. Переход от одной фазы вещества к другой сопровождается изменением внутренней энергии системы.
Одно и то же вещество в твёрдом и жидком состояниях может иметь по нескольку различных фаз.
Твердые тела характеризуются высокой механической прочностью.
По сравнению с твердыми телами жидкости характеризуются большой подвижностью молекул, и как следствие, меньшей упорядоченностью молекул и их слабым взаимодействием.
Кроме кристаллов к твёрдым телам относя аморфные и жидкие кристаллы.
Аморфные тела – это твёрдые тела, в которых соблюдается только ближний порядок в расположении частиц и отсутствует определенная температура плавления. ряд явлений, присущих только жидкому состоянию вещества.
Среди свойств жидкости особую роль играют такие свойства, как поверхностное натяжение и смачивание. Молекулы поверхностного слоя жидкости находятся в условиях, отличающихся от условий существования молекул внутри её объёма.

На каждую молекулу поверхностного слоя действует результирующая сила со стороны остальных молекул, направленная вовнутрь жидкости. Таким образом, жидкость как будто находится под натянутой пленкой.
Поэтому, если жидкость оказывается без стенок сосуда и в условиях невесомости, то она приобретает форму с мини минимальной площадью поверхности, т.е. шара.
Среди свойств жидкости особую роль играют такие свойства, как поверхностное натяжение и смачивание.
При увеличении площади поверхности жидкости на некоторую величину внешними силами совершается работа.
Отношение этой работы к изменению площади поверхности называется коэффициентом поверхностного натяжения

На рисунке изображена проволочная рамка с одной подвижной стороной, на которую «натянута» мыльная плёнка.

Прикладывая внешнюю силу можно растягивать эту пленку, совершая работу против силы поверхностного натяжения.
Из формулы для работы внешних сил найдём
 ,
,
откуда 
Учитывая тот факт, что у мыльной пленки две поверхности натяжения,

получим ещё одну формулу для коэффициента поверхностного натяжения жидкости

Коэффициент поверхностного натяжения равен силе, действующей со стороны поверхности жидкости на единицу длины контура (границы) поверхности и стремящейся уменьшить площадь этой поверхности.
Рассмотрим границу между жидкой и твердой фазой на примере жидкости в цилиндрическом сосуде.

Твердое тело – стенка сосуда. Влиянием газовой фазы пренебрегаем. Если молекулы жидкости, находящиеся вблизи границы Т-Ж( твёрдое тело – жидкость) на ее свободной поверхности, притягиваются к твердому телу сильнее, чем к жидкости, то они «вытягивается» из жидкости в сторону твердого тела, т.е. увеличивается площадь границы Т-Ж. И наоборот. Если силы притяжения молекул из граничной области к жидкой фазе больше, чем к твердой, то площадь границы Т-Ж стремится к уменьшению. Получающийся на границе угол края жидкости к твердому телу называется углом смачивания.
Если этот угол меньше 900, говорят имеет место смачивание; если – больше 900, несмачивание. Если угол равен 00 , то такое явление называется растеканием (говоря другими словами - очень хорошее смачивание).
Поверхностное натяжение и смачивание является причиной такого явления как капиллярность - необычного поведения жидкостей в тонких трубках (капиллярах) и узких щелях.
В зависимости от смачивания или несмачивания жидкость в капиллярах может иметь высоту подъёма больше или меньше уровня свободной поверхности жидкости в большом сосуде. Формула высоты уровня жидкости в капилляре для случая идеального смачивания имеет вид

Разбор тренировочных заданий
1. На рисунках изображены разные моменты опыта по измерению высоты поднятия жидкости в капилляре.
Расположите рисунки в правильной временной последовательности.

Решение. В опыте капилляр опускается в жидкость, и жидкость поднимается до некоторого предельного уровня. Учитывая эту последовательность, расставим картинки

2. Ответьте на вопросы:
1.Найдите радиус капилляра (мм), если известно, что

2.Чему равен угол смачивания, если жидкость растекается по поверхности твердого тела?
3.Чему равен угол смачивания, если жидкость не смачивает твердое тело?
4.Приведите номер рисунка, верно отражающего явление капиллярности

5. выберите номер капилляра, в котором жидкость поднимется выше? Если


Решение.
1.Из формулы для высоты поднятия жидкости в капилляре в случае хорошего смачивания имеем

Отсюда получим выражение для радиуса

вычислим r = (2*0,1)/(800*10*0,025) =0,001 м = 1 мм;
2.Если жидкость растекается, угол смачивания равен нулю (00);
3.Есмли жидкость не смачивает твёрдое тело, угол смачивания равен 1800;
4.Если в одну и ту же жидкость опустить два капилляра из одного и того же материала, смачивающегося данной жидкостью, но разного радиуса, то чем меньше радиус капилляра, тем больше высота уровня жидкости в капилляре. Верный вариант – 2;
5. Считаем по формуле:

h1 = (2*0,1)/(800*10*0,0015) =0,01666 м =16,7 мм;
h2 = (2*0,05)/(1000*10*0,0005) =0,02 м = 20 мм
Ответ:1; 0; 180; 2; 2.
Плотность вещества
Плотностью вещества называется величина, численно равная массе единицы объёма этого вещества.
Каждое вещество занимает некоторый объём. И может оказаться, что объёмы двух тел равны, а их массы различны.
 В этом случае говорят, что плотности этих веществ различны.
В этом случае говорят, что плотности этих веществ различны.
Рассмотрим кусок железа, масса которого равна 1 кг, и кусок дерева, масса которого равна 1 кг. Объём дерева больше, чем объём куска железа. Плотность дерева меньше, чем плотность железа (молекулы прилегают не так плотно друг к другу). 
Плотность равна отношению массы тела к его объёму.
В физике плотность обозначают греческой буквой
Основной единицей плотности вещества является
Пример:
Плотность железа равна 7900
Плотность воды равна 1000
Выражая по-другому, плотность воды равна 1
В различных состояниях плотность вещества различна.
Например, плотность расплавленного железа меньше плотности твёрдого железа.
Плотности веществ могут быть очень различны. Самое плотное вещество не находится на Земле.
Например, в космосе плотность белого карлика Сириуса Б (звезда) так велика, что масса спичечного коробка из этого вещества была бы равна 127 тоннам.
Пример:
10 вёдер вместимостью 1 литр до краёв наполнены мёдом, масса всего мёда равна 14 кг. Найди плотность мёда.
Лабораторная работа « Определение плотности твёрдого тела»
Цель – научиться определять плотность твёрдого тела с помощью рычажных весов и мензурки.
Оборудование: рычажные весы, разновесы, мензурка с водой, машинка.
Ход работы:
1.Исходное состояние
2.Поместим на левую чашу весов машинку.
3. Поместим на правую чашу весов грузы из набора, чтобы уравновесить весы. Подсчитаем массу машинки: m=
4. Определим объём воды V1 до погружения машинки
5.Определим объём воды V2 вместе с погруженной в неё машинкой.
6.Вычислим объём машинки, найдя разницу объёмов: V=V2-V1
7.Вычислим среднюю плотность материала из которого сделана машинка по формуле:
6.Результаты измерений и вычислений занесём в таблицу:
m, г | V1, см3 | V2, см3 | V, см3 |
|
244,8 | 50 | 100 | 50 | 4,896 |
Вывод: средняя плотность материала из которого сделана машинка равна 4,896 г/ см3.
ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ( МКТ)
Молекулярно-кинетическая теория - теория, объясняющая тепловые явления в макроскопических телах и свойства этих тел на основе их молекулярного строения.
Основные положения молекулярно-кинетической теории:
- вещество состоит из частиц - молекул и атомов, разделенных промежутками,
- эти частицы хаотически движутся,
- частицы взаимодействуют друг с другом.
- МАССА И РАЗМЕРЫ МОЛЕКУЛ
Массы молекул и атомов очень малы. Например, масса одной молекулы водорода равна примерно 3,34*10 -27 кг, кислорода - 5,32*10 -26 кг. Масса одного атома углерода m0C=1,995*10 -26 кг
Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:(атомная единица массы).
Количество вещества - это отношение числа молекул N в данном теле к числу атомов в 0,012 кг углерода NA:
Моль - количество вещества, содержащего столько молекул, сколько содержится атомов в 0,012 кг углерода.
Число молекул или атомов в 1 моле вещества называют постоянной Авогадро:
Молярная масса - масса 1 моля вещества:
Молярная и относительная молекулярная массы вещества связаны соотношением: М = Мr*10 -3 кг/моль.
СКОРОСТЬ ДВИЖЕНИЯ МОЛЕКУЛ
Несмотря на беспорядочный характер движения молекул, их распределение по скоростям носит характер определенной закономерности, которая называется распределением Максвелла.
График, характеризующий это распределение, называют кривой распределения Максвелла. Она показывает, что в системе молекул при данной температуре есть очень быстрые и очень медленные, но большая часть молекул движется с определенной скоростью, которая называется наиболее вероятной. При повышении температуры эта наиболее вероятная скорость увеличивается.
ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьётся о стенку сосуда. Расчёты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
где – масса одной молекулы газа,
– концентрация молекул,
– среднее значение квадрата скорости молекул.
Коэффициент обусловлен трёхмерностью пространства – во время хаотического движения молекул все три направления равноправны.
Средняя кинетическая энергия поступательного движения
,
тогда уравнение примет вид:
.
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Сила удара молекул о стенку сосуда
Выберите газ, который находится в сосуде. Измените температуру и посмотрите, с какой скоростью движутся молекулы.
Число молекул:
Масса молекул:
Давление газа на стенку сосуда обусловлено ударами молекул. Давление газа пропорционально концентрации молекул: чем больше молекул в единице объёма, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передаёт ей импульс, пропорциональный импульсу молекулы .
Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьётся о стенку сосуда. Расчёты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
где – масса одной молекулы газа,
– концентрация молекул,
– среднее значение квадрата скорости молекул.
Коэффициент обусловлен трёхмерностью пространства – во время хаотического движения молекул все три направления равноправны.
Средняя кинетическая энергия поступательного движения
,
тогда уравнение примет вид:
.
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Сила удара молекул о стенку сосуда
Выберите газ, который находится в сосуде. Измените температуру и посмотрите, с какой скоростью движутся молекулы.
Число молекул:
Идеальный газ - это упрощенная модель газа, в которой:
- молекулы газа считаются материальными точками,
- молекулы не взаимодействуют между собой,
- молекулы, соударяясь с преградами, испытывают упругие взаимодействия.
Иными словами, движение отдельных молекул идеального газа подчиняется законам механики. Реальные газы ведут себя подобно идеальным при достаточно больших разрежениях, когда расстояния между молекулами во много раз больше их размеров.
Основное уравнение молекулярно-кинетической теории можно записать в виде
Скорость ![]() называют средней квадратичной скоростью.
называют средней квадратичной скоростью.
ТЕМПЕРАТУРА
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия.
Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Абсолютный нуль температуры - предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении.
Термометр - прибор для измерения температуры. Обычно термометры градуируют по шкале Цельсия: температуре кристаллизации воды (таяния льда) соответствует 0°С, температуре ее кипения - 100°С.
Кельвин ввел абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия:
Связь температуры в энергетических единицах и температуры в градусах Кельвина:
где k = 1,38*10 -23 Дж/К - постоянная Больцмана.
Связь абсолютной шкалы и шкалы Цельсия:
T = t + 273
где t - температура в градусах Цельсия.
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре:
Средняя квадратичная скорость молекул
Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так:
p=nkT
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Пусть газ массой m занимает объем V при температуре Т и давлении р, а М- молярная масса газа. По определению, концентрация молекул газа: n = N/V, где N-число молекул.
Подставим это выражение в основное уравнение молекулярно-кинетической теории:
Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде
называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ).
1. Изотермический процесс
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Если Т =const, то
Закон Бойля-Мариотта
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const
График процесса, происходящего при постоянной температуре, называется изотермой.
2. Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Закон Гей-Люссака
Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
Если газ, имея объем V0 находится при нормальных условиях: ![]() а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
Обозначив
получим V=V0![]() T
T
Коэффициент ![]() называют температурным коэффициентом объемного расширения газов. График процесса, происходящего при постоянном давлении, называется изобарой.
называют температурным коэффициентом объемного расширения газов. График процесса, происходящего при постоянном давлении, называется изобарой.
3. Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const , то
Закон Шарля
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре:
Если газ, имея объем V0,находится при нормальных условиях:
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать
График процесса, происходящего при постоянном объеме, называется изохорой.
Пример. Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12°С, если масса этого воздуха 2 кг?
Из уравнения состояния идеального газа
определим величину давления:
Ответ: давление сжатого воздуха равно 8,2 *10 6 Па.
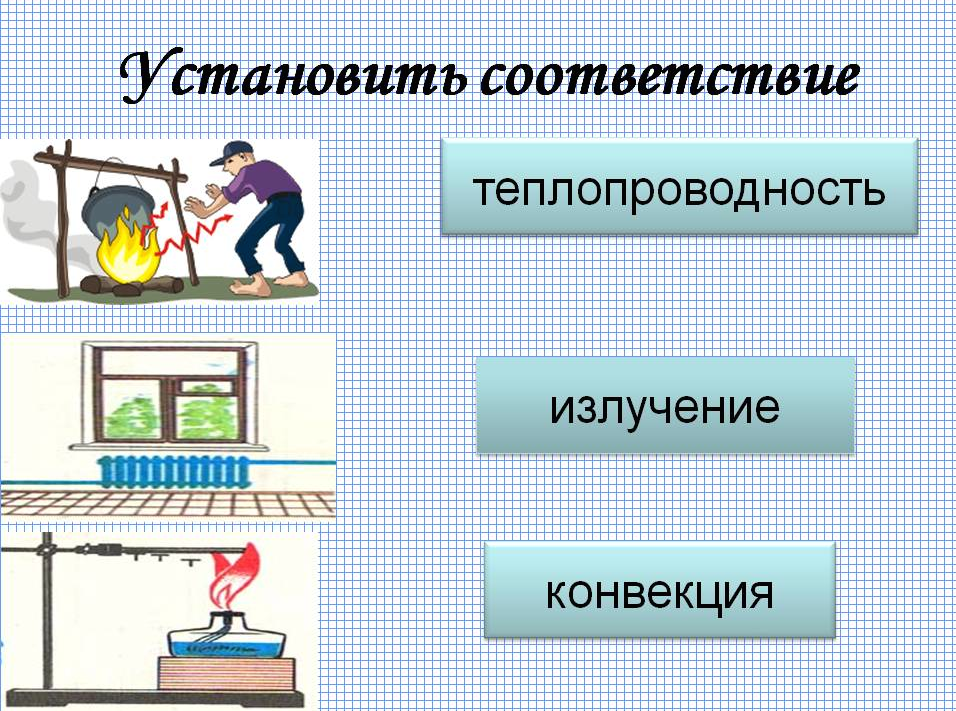
Теплопроводность. Конвекция. Излучение
На
этом уроке
Вы
узнаете:
·
Что такое теплопроводность.
·
Как различаются теплопроводности веществ.
·
Что такое конвекция.
·
Какие виды конвекции существуют.
·
Что такое излучение.
Ключевые слова
Теплопроводность; конвекция; излучение.
Основное содержание
урока
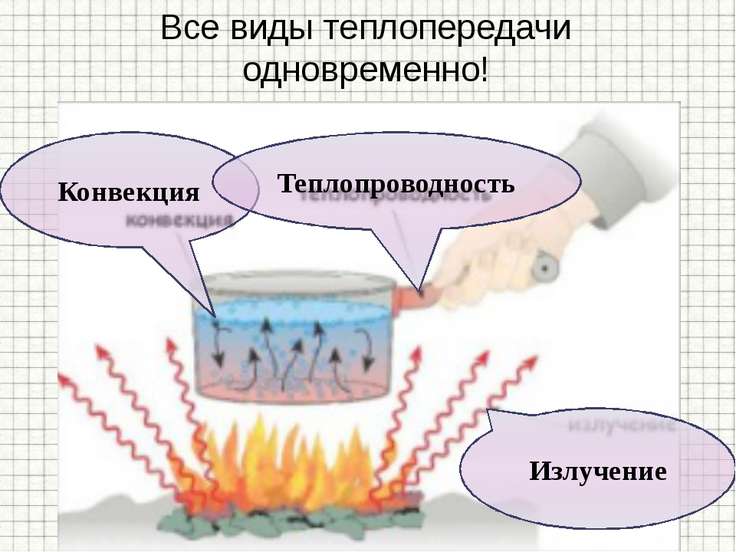
1.
Явление передачи
внутренней энергии от одной части тела к другой или от одного тела к другому
при их непосредственном контакте называют теплопроводностью.
Передача энергии при нагревании проволоки
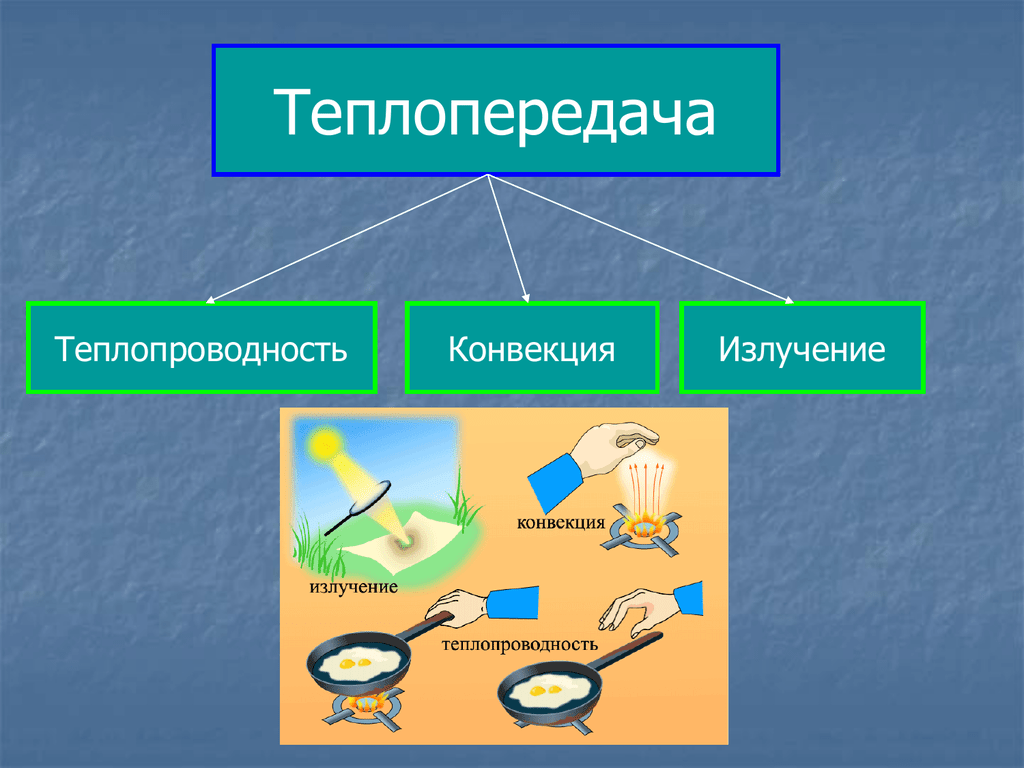
2.
Теплопередача, обусловленная
переносом вещества, называется конвекцией.
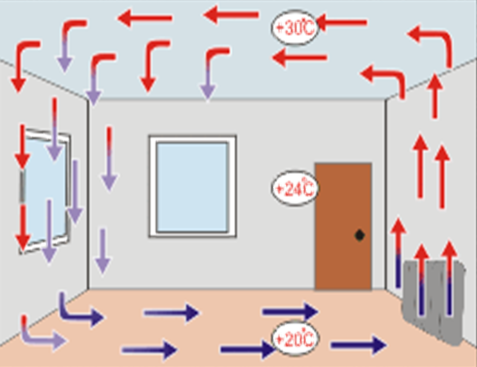
Конвекция наблюдается только в жидкостях и газах, например, при
работе отопительных приборов.
Различают два вида конвекции: естественную
и вынужденную.
Естественная
конвекция Вынужденная конвекция
Явление конвекции
очень распространено в природе.
Образование дневного бриза Образование ночного бриза
3.
Излучение — вид
теплопередачи, при котором энергия передаётся не только при наличии вещества,
но и в вакууме.
4.
Термоскоп — устройство, которое показывает изменения
температуры, родоначальник современных термометров.
Передача
энергии от нагретого тела к термоскопу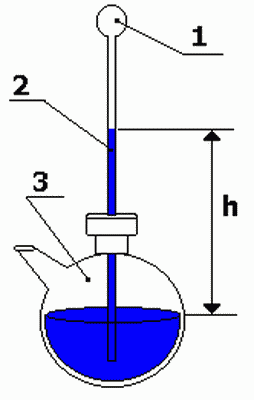
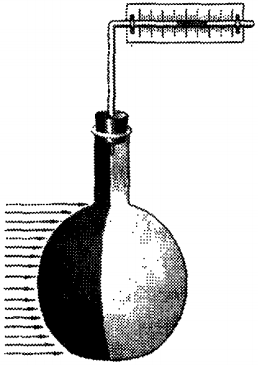
5. Тела со светлой поверхностью хуже
нагреваются при теплопередаче путём излучения, чем тела с тёмной
поверхностью.
6. Для сохранения пищевых продуктов при определённой температуре в
быту используется термос.
Разбор типового
тренировочного
задания
Выберите верный ответ. Теплопередача не
происходит путём:
·
механического движения
·
излучения
·
теплопроводности
·
конвекции
Ответ: механического движения.
Разбор типового
контрольного
задания
Выберите верные утверждения:
·
Тёмная одежда в солнечную погоду нагревается
сильнее, чем светлая, так как светлая одежда лучше поглощает энергию, чем
тёмная.
·
В термосе поверхность сосуда покрывают
блестящим металлическим слоем, чтобы уменьшить потери энергии путём излучения.
·
Термоскоп служит для обнаружения теплового
излучения.
·
Воздух плохой проводник тепла.
Ответ: 2, 4.
Рассмотрим первый вид парообразования — испарение.
Парообразование, происходящее с поверхности жидкости, называется испарением.
Испарение происходит при любой температуре. При испарении молекулы покидают жидкость, энергия жидкости уменьшается, значит, температура жидкости тоже уменьшается.
Поэтому, когда мы выходим после купания из речки, озера или даже бассейна, мы ощущаем холод. При этом в ветреную погоду испарение происходит интенсивнее, и будет холоднее, чем в безветренную.
Обрати внимание!
Наблюдения и опыты показывают, что испаряются и твёрдые тела.
Испаряется, например, лёд, поэтому бельё высыхает и на морозе. Испаряется нафталин, поэтому мы чувствуем его запах.
При тушении некоторых пожаров используют легкоиспаряющиеся жидкости.
Второй вид парообразования — это кипение.
Кипение — это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и внутри неё.
Кипение происходит при одной температуре, которая для каждого вещества имеет определённое значение.
Известно, что одновременно с испарением происходит переход молекул из пара в жидкость.
Явление превращения пара в жидкость называется конденсацией.
Конденсация пара сопровождается выделением энергии.
Летним вечером, когда воздух становится холоднее, выпадает роса. Это водяной пар, находящийся в воздухе, при охлаждении конденсируется, и капельки воды оседают на траве.
Другие примеры конденсации:
- образование облаков;
- запотевание окон и крана с холодной водой;
- образование тумана у носика чайника.


Вы уже изучили такой вид парообразования как испарение.
Рассмотрим второй способ образования пара — кипение.
Кипение — это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и по всему объёму.
Рассмотрим пример — кипение воды.
В воде растворены молекулы воздуха (газов). При нагревании этот растворённый газ выделяется в виде воздушных пузырьков на дне и стенках сосуда.
С повышением температуры жидкости внутри этих пузырьков испаряется вода, они увеличиваются в размерах. Достигнув определённого размера, пузырьки отрываются от поверхности.
Если вода прогрета недостаточно, то пузырьки пара в холодных слоях схлопываются. А если температура достаточная, то они достигают поверхности воздуха или жидкости и лопаются, выпуская пар. В этот момент слышен шум, предшествующий обычно кипению. При определённой температуре вода закипает.
Температуру, при которой жидкость кипит, называют температурой кипения.
Обрати внимание!
Во время кипения температура жидкости не изменяется, так как вся энергия расходуется на парообразование.
Температура кипения жидкости зависит от двух факторов:
- от рода жидкости;
- от внешнего давления.
Для каждого вещества существует своя температура кипения.
| Вещество | Температура кипения (при норм. атм. давлении), °С |
| воздух | |
| кислород | |
| эфир | |
| спирт | |
| вода | |
| ртуть | |
| свинец | |
| медь |
При уменьшении давления воздушным пузырькам легче всплывать, кипение происходит при меньшей температуре. Именно поэтому высоко в горах (на высотах
Различные жидкости одной и той же массы требуют разное количество теплоты для их обращения в пар при температуре кипения.
Удельная теплота парообразования (L) — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Влажность воздуха. Обобщение по теме «Изменения агрегатного состояния вещества»
Вода покрывает две трети поверхности Земли.
С поверхностей рек, морей, водоёмов при любой температуре происходит испарение. Следовательно, в воздухе постоянно находится водяной пар. Наличие водяного пара в воздухе и показывает влажность воздуха.
Для определения содержания влаги в воздухе используют понятия абсолютной и относительной влажности.
Обрати внимание!
Абсолютная влажность
Чтобы судить о степени влажности воздуха, важно знать, близок или далёк водяной пар, находящийся в воздухе, от состояния насыщения. Для этого вводят понятие относительной влажности.
Относительной влажностью воздуха
Относительную влажность воздуха можно определить по формуле:
Чем больше будет содержание водяного пара в воздухе при данной температуре, тем больше влажность воздуха, и тем ближе пар к состоянию насыщения.
Если влажный воздух охлаждать, то при некоторой температуре находящийся в нём пар можно довести до насыщения. При дальнейшем охлаждении водяной пар начнёт конденсироваться в виде росы, может появиться туман.


Температура, при которой пар, находящийся в воздухе, становится насыщенным, называется точкой росы.
Точкой росы также характеризуется влажность воздуха.
Приборы для измерения влажности воздуха
Гигрометр и психрометр — это приборы, которые служат для определения влажности воздуха.
Гигрометр бывает:
- весовой;
- конденсационный;
- волосной;
- керамический;
- электронный.
На рисунке показаны электронный и керамический гигрометры.


А более подробно мы рассмотрим строение психрометра.
Он состоит из двух термометров. Один термометр (сухой) показывает температуру воздуха, а другой (влажный) термометр обмотан тканью, конец которой опущен в воду. Он тоже показывает температуру, но всегда меньше сухого термометра, т.к. вода испаряется и термометр охлаждается.
Чем больше относительная влажность, тем менее интенсивно идёт испарение. Значит, разность показаний термометров будет меньше.
По этой разности температур и определяют относительную влажность воздуха с помощью психрометрической таблицы.
Нормальная влажность воздуха в жилых помещениях — около